 Гальваническая коррозия. Гальванический элемент. Коррозия.
Гальваническая коррозия. Гальванический элемент. Коррозия.
Содержание
Уже много лет назад было замечено, что, чем чище цинк, чем меньше он содержит различных примесей, в частности таких металлов, как медь, железо, свинец или олово, тем медленнее он растворяется. Чистый цинк может долгое время лежать без всяких изменений даже в растворе крепкой соляной кислоты.
Цинковый гальванический элемент. Цинк и соляная кислота.
Почему чистый цинк не растворяется в соляной кислоте, в то время как загрязненный цинк растворяется очень быстро?
Впервые на этот вопрос дал ответ швейцарский ученый Артур де-ля-Рив, который заметил, что пузырьки выделяются неравномерно на всей поверхности металла, а именно: в одних местах пузырьков выделяется много, а в других — совсем мало.
Де-ля-Рив высказал предположение, что выделение водорода на отдельных местах цинковой пластинки представляет результат работы мелких гальванических элементов, в которых катодом являются посторонние примеси, находящиеся в металле, а анодом сам цинк.
В то время (200 лет назад) науки о металлах не существовало, не было известно строение металлов, мало что было известно и об электричестве. Лишь за последние 70—80 лет после долгих исследований многих ученых накопился богатый опытный материал, развилась наука о металлах и сплавах, и теория электрохимической коррозии, сущность которой мы рассмотрели, получила общее признание. Коррозия металлов в растворах электролитов рассматривается сейчас как результат действия (работы) множества мельчайших, порой даже невидимых под микроскопом гальванических элементов, находящихся на поверхности металла.
Если мы понаблюдаем за растворением кусочков цинка в растворе соляной кислоты, то обнаружим, что загрязненный цинк сначала растворяется медленно, а по мере разрушения скорость начинает возрастать. Чтобы понять это явление, рассмотрим рисунок 1.

Рис.1. Увеличение числа микрокатодов при растворении цинка.
В начале процесса растворения кусочка цинка в кислоте на его поверхности имеется сравнительно немного микроэлементов, так как еще не все примеси, заключенные в толще кусочков цинка, оказались на его поверхности. Однако по мере разрушения цинка на поверхности его оказывается все больше и больше примесей, т. е. количество микроэлементов растет, и процесс разрушения металла ускоряется. Это связано с тем, что в процессе растворения цинка растворяться будет только чистый цинк, примеси же, играющие роль микрокатодов, не растворяются. Вскоре на поверхности кусочка цинка образуется рыхлый слой различных примесей, нерастворимых в кислоте. Этот слой получил название «губки» (так как по форме он напоминает губку).
Осторожно снимем эту губку с поверхности металла. Скорость растворения его замедлится. Если теперь возьмем отдельный кусочек губки и прикоснемся им к кусочку цинка, скорость коррозии опять возрастет. Это можно заметить по усиленному выделению водорода на губке. В последнем случае мы создаем систему, состоящую из кислоты, цинка и губки (примесей). Эта система ничем не отличается от простейшего гальванического элемента.
Возьмем две пластинки из одного и того же металла. Поверхность одной из пластинок зачистим грубой наждачной бумагой, а другую отполируем до зеркального блеска. Опустим пластинки в кислоту, предварительно соединив их проволокой. При этом можно видеть, что пластинка, обработанная грубой наждачной бумагой, будет растворяться, что заметно по потере ею блеска, а на шлифованной пластинке будут выделяться пузырьки газа. Этот опыт показывает, что различная обработка металла ведет также к возникновению гальванического элемента.
Крупный гальванический элемент. Алюминий
Иногда гальванические элементы, возникающие на металлических изделиях, имеют электроды весьма громадных размеров, например, когда один металл соприкасается с другим — закрепленный в металлической конструкции болт или заклепка из другого металла. Так если из листового алюминия при помощи медных или латунных заклепок делают бак для воды, то медные заклепки будут здесь играть роль катодов, а алюминиевые листы станут анодными и, следовательно, начнут разрушаться (рис. 2).
Гальваническая коррозия. Гальванический элемент. Коррозия.
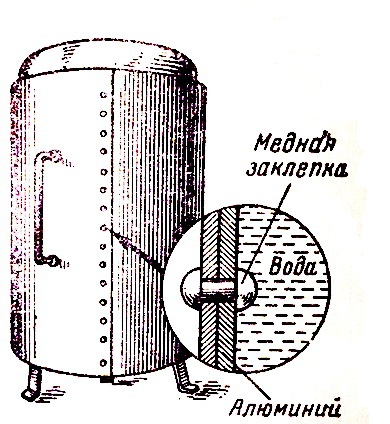
Рис.2. Крупный гальванический элемент на металлической конструкции.
Рисунок 3 представляет фотографию листового электрона (сплава магния и алюминия) с медными заклепками после того, как он находился в растворе поваренной соли.
Конструкторы, по проектам которых делают различные сооружения, не зная механизма электрохимической коррозии, могут допустить очень грубую ошибку. Такая ошибка была допущена при строительстве морской яхты «Штандарт». Эта яхта была предназначена для увеселительных прогулок, и конструктор постарался сделать ее как можно более красивой. Надводную часть яхты он покрыл листами из меди, а подводная была сделана из стальных листов.

Рис.3. Коррозия листового электрона с медными заклепками в 3-процентном растворе поваренной соли (продолжительность опыта 5 часов).
Применяя сталь для подводной части яхты, конструктор хотел подводную часть сделать более прочной, однако получился конфуз. На месте соприкосновения медных и железных листов началась интенсивная коррозия, и подводная часть яхты стала быстро разрушаться. Почему она быстро разрушалась, теперь мы понимаем. Конструктор, сам того не желая, искусственно создал систему уже не микро-, а макрогальванических элементов. Электролитом для работы этой гальванической пары служила морская вода.
При электрохимическом разрушении металла, как мы уже указали, количество микрогальванических элементов растет. Таким образом, здесь коррозия металла усиливает скорость дальнейшего разрушения. Коррозия способствует дальнейшему развитию коррозии.