Строение металлов. Часть 2.
Кристаллическая решетка сплавов
Имеют ли сплавы кристаллическую решетку и как она построена?
Содержание
Разберем сначала, как получают сплавы. Их получают путем сплавления одних металлов с другими или металлов с неметаллами. Многие расплавленные металлы хорошо растворяются один в другом и дают твердый раствор. Медь хорошо растворяется в никеле, свинец — в сурьме и т. д.
Свойства сплава зависят.
Их свойства зависят не только от того, какие химические элементы входят в состав сплава, но и от структуры сплава, т. е. от того, как построена кристаллическая решетка сплава. Изучение сплавов показало, что составные части сплава могут образовать либо механическую смесь, когда при затвердевании сплава отдельные, составляющие его вещества образуют кристаллы, равномерно распределяющиеся в толще всего металла, или химические соединения, т. е. когда один из металл образует новое вещество с новыми химическими и физическими свойствами.
Механическая смесь.
Что такое механическая смесь? Вы знаете, что такую смесь можно получить из порошка железа и серы, причем эти вещества легко можно отделить друг от друга. Например, при взбалтывании в воде сера всплывает на поверхность, а металлический порошок железа оседает на дно.
Такого рода механические смеси встречаются и среди сплавов. Например, свинец и сурьма — это механическая смесь.

Рис.7. Сплав свинца с сурьмой (схема структуры)
Рассматривая такие сплавы в микроскоп, можно различить отдельные мельчайшие кристаллики свинца и сурьмы (рис. 7). Механическую смесь дает также алюминий с кремнием и висмут с кадмием. В твердых растворах металлы могут растворяться один в другом. При этом атомы одного металла равномерно распределяются в другом. При застывании атомы растворенного металла остаются рассеянными в другом металле, образуя твердый раствор. К таким растворам относят железо и углерод, железо и никель, железо и хром и др.
Металлы и их соединения.
Как же здесь построена кристаллическая решетка? Исследованиями многих ученых доказано, что твердые растворы могут быть построены по-разному. В том случае, когда твердый раствор содержит металлы, атомы которых имеют приблизительно одинаковые размеры, атомы растворенного металла не занимают каких-либо особых положений. Они замещают атомы растворителя в любом месте кристаллической решетки. Эти сплавы называют твердыми растворами замещения (рис. 8,а), к ним относятся сплавы железа с хромом, железа с никелем, железа с марганцем, сплав меди с никелем и кобальтом.
Однако могут быть такие твердые растворы, когда атомы растворителя по своим размерам отличаются от атомов растворенного вещества. В этом случае атомы растворяющегося элемента внедряются в промежутки кристаллической решетки между атомами растворителя. Такого рода твердые растворы называют растворами внедрения (рис. 8,б). Чаще всего растворы внедрения образуются при сплавлении металлов с неметаллами.
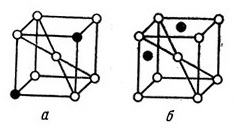
Рис.8. Строение твердых растворов:
а-раствор замещения; б-раствор внедрения.
Иногда при сплавлении отдельные частицы сплава могут соединяться с другими, образуя новое химическое вещество. Так, например, вольфрам соединяется с углеродом и получается новая составная часть — карбид вольфрама. Кристаллы химических соединений существуют в структуре сплава самостоятельно как одно из составных частей механической смеси или твердого раствора. Они обычно отличаются большой твердостью и хрупкостью. Особенно хрупки карбиды вольфрама, хрома, титана и др.
При нагревании металлов, так же, как и всех твердых кристаллических веществ, ноны, закрепленные в узлах кристаллической решетки, начинают колебаться все сильнее, и до тех пор, пока решетка сохраняется, кристалл остается твердым телом. Когда колебания ионов усиливаются настолько, что решетка разрушается, появляются первые следы жидкости. Поэтому все кристаллические вещества, в том числе и металлы, имеют совершенно определенную температуру плавления. Эта температура обусловливается прочностью связи атомов в кристаллической решетке. Наиболее легкоплавкий металл—ртуть, она плавится при температуре —38,87° С.
Наиболее высокоплавким металлом является вольфрам, температура плавления которого 3380° С.
Строение металлов. Часть 2.
Свойства металлов.
Металлы обладают высокой теплопроводностью. Большинство же неметаллических веществ, например, вода, стекло, воздух, дерево, кирпич, малотеплопроводны.
Как известно, наибольшей электропроводностью обладают серебро и медь. За ними следуют золото, хром, алюминий, марганец, вольфрам. Железо сравнительно плохо проводит электрический ток. Наименьшая теплопроводность у титана. Она в 300 раз меньше, чем, например, у серебра. Наилучшие проводники электрического тока обладают и наибольшей теплопроводностью. Следовательно, такие свойства металлов, как теплопроводность и электропроводность, связаны с их кристаллической решеткой. В дальнейшем мы сможем наблюдать, что стойкость металла к коррозийному воздействию напрямую зависит от его кристаллической решетки
Скорость коррозии.
Скорость разрушения металла различна. Разные виды металлических приборов, используемые в повседневном быту, не подвергаются видимой коррозии, но если бросить один из таких приборов в траву и оставить его на несколько дней, то он покроется пятнами ржавчины. Также, можно рассмотреть покрашенные трубы, используемые дома, и трубы, зарытые на улице, под землей, в этом случае трубы, которые пролегают под землей придут в негодность быстрее. Значит, можно сказать, что от условий в которых находится металл, зависит скорость разрушения и соответственно коррозия металла.
Установлено, что все виды металлов стремятся к своему естественному состоянию, к такому, какими они находились в природе. Даже если оставить металл при комнатной температуре и в условии сухого воздуха, он все равно потускнеет и станет матовым. На его поверхности образовывается тончайшая пленка окислов, она образуется благодаря химического взаимодействия кислорода воздуха с металлом.
Скорость коррозии может увеличиваться с повышением температуры. Кислород воздуха вступает в реакцию с поверхностными атомами металла, из-за чего образуется пленка окислов. В зависимости от прочности пленки она может препятствовать дальнейшей коррозии. Самые прочные пленки образуются на поверхностях алюминия и цинка. Пленки такого рода называются защитными. Значит, можно сказать, что коррозия не только разрушает металлы, но и защищает его.
Несколько иного характера пленки, появившиеся на железе. При высоких температурах на его поверхности образуются довольно прочные пленки. При нагревании слитков железа или стали до температуры 1200 — 1300° С могут получаться пленки толщиной в несколько миллиметров, а иногда при нагревании больших слитков толщина слоя окисла достигает 1 см. Пленки, образующиеся на железе при его нагревании, получили название окалины. Окалина обладает большой твердостью и хрупкостью. Она разными способами удаляется с поверхности металла.
На металл оказывает влияние не только кислород воздуха, но газы и пары воды, находящиеся в атмосфере. Например, сернистый газ, вступая во взаимодействие с поверхностью металла, разрушает его. Двуокись углерода, наоборот, вступая в соединение с поверхностными атомами металла, образует тонкую, прочную пленку, предохраняющую его от дальнейшего разрушения.
В зависимости от химической природы металла, строения его металлической решетки скорость образования окисных пленок может быть различной. Возьмем, например, натрий, который легко режется ножом и имеет температуру плавления 97,7° С. Разрезав его, мы обнаружим блестящую поверхность, которая будет буквально на глазах тускнеть. Через одни-двое суток на поверхности разреза образуется пленка, состоящая из окислов натрия, а также из углекислого натрия — продуктов соединения натрия и воды, находящейся в воздухе, с двуокисью углерода. Эта пленка не предохраняет поверхность натрия от воздействия на него среды. И если оставить натрий на воздухе, то через некоторое время он превратится в подобного рода химическое соединение металлический натрий быстро разрушится. Поэтому его хранят под слоем керосина.
Таким образом, окисные пленки различны: одни из них образуют на поверхности металла прочную защиту другие же — рыхлые, непрочные и не защищают его поверхность от дальнейшего разрушения.
Поэтому естественно, что ученые задались целью изучить образующиеся пленки. В результате различных методов, которые применялись для их изучения, было установлено, что все пленки по толщине можно разделить на три группы:
на невидимые, которые можно обнаружить только специальными методами, толщина их не более 400 Å (ангстрем);
пленки, дающие цвета побежалости, толщиной от 400 до 5000 Å;
видимые пленки, толщина которых более 5000 Å.
Невидимые пленки трудно обнаружить. Ученым Тронстадом был разработан очень интересный метод, который позволил распознавать и даже измерять чрезвычайно тонкие пленки. Этот метод по своей идее прост — он состоит в исследовании изменений, которые претерпевает луч падающего света на поверхность металла, имеющего пленку.
Для иллюстрации метода исследования тонких пленок проделаем следующий опыт. Поверхность металлической пластинки тщательно очистим тонкой наждачной бумагой и, взяв такую пластинку деревянной держалкой, будем нагревать ее с одного конца на газовой или спиртовой горелке до температуры 250— 300° С (рис. 9). Постепенно на поверхности металла появятся так называемые цвета побежалости, т. е. поверхность пластинки окажется окрашенной во все цвета радуги. Появление такого рода окраски объясняется возникновением на металле пленок различной толщины.
Строение металлов. Часть 2.

Рис.9. Образование цветов побежалости.
Почему же наличие тонких пленок приводит к такой причудливой окраске металлической поверхности? Чем объяснить появление цветов побежалости?
Исследование показало, что цвета побежалости представляют оптической явление, не связанное с окраской поверхности металла. Чтобы понять это, рассмотрим рис. 10. На этом рисунке схематически изображена поверхность металла с образовавшейся на ней пленкой окислов (Б-А). Свет падающий на металл, частично отражается от ее поверхности, а частично проходит через пленку и отражается от поверхности металла. Вам известно, что лучи видимого света представляют собой волны той или иной длины. При определенном соотношении между толщиной пленки и длиной волны падающего луча оба отраженных луча от пленки и металла, сложившись, могут погасить друг друга, в результате чего часть лучей определенного цвета в отраженном луче будет сильно ослаблена, поэтому пленка покажется нам окрашенной в один из дополнительных цветов. Когда толщина пленки достигнет определенной величины, цвета побежалости исчезают: пленка становится малопрозрачной и полностью поглощает лучи света.
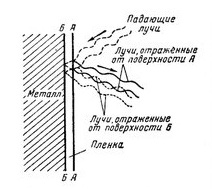
Рис. 10. Метод определения окисных пленок.
Было замечено, что цвета побежалости зависят не только от толщины пленки, но и от металла, на котором она образовалась. Была составлена специальная таблица, которая дает возможность по цветам побежалости приблизительно определять и толщину пленок. Очень тонкие пленки не дают цветов побежалости, и поэтому они долгое время не поддавались изучению. В настоящее время разработаны методы, позволяющие изучать и эти чрезвычайно тонкие пленки.
Как влияют пленки на защитные свойства металлов, можно обнаружить простым методом. Возьмем железную пластинку, путем нагревания получим на ней цвета побежалости. Будем на каждую зону, окрашенную в один цвет наносить каплю разбавленного раствора медного купороса. Нанесем сначала каплю на поверхность металла где нет цветов побежалости, т. е. не образовалось видимых окисных пленок. Под каплей на металле сейчас же обнаружим покраснение, указывающее на образование меди на этом участке. Эта реакция Вам известна. Так, если опустить в раствор медного купороса железный гвоздь или пластинку, то уже через несколько минут поверхность металла покроется красноватым налетом меди. Здесь происходит реакция, которую можно записать уравнением:
CuSO4+Fe→Cu+FeSO4
То же самое получается и при нанесении капли медного купороса на поверхность железной пластинки. Капля тотчас же вызывает появление пятна на поверхности незащищенного металла. Несколько медленнее происходит его появление на желтой окраске, и пятно долго не возникает на серо-зеленой поверхности. Это указывает на то, что пленки обладают различными защитными свойствами в зависимости от их толщины.