Строение металлов
Металлы под микроскопом
Содержание
Все металлы состоят из огромного количества кристаллических зерен, которые соединяются между собой. Такое зернистое кристаллическое строение вещества можно увидеть, применяя специальные микроскопы, получившие название металлографических. Они отличаются от обычных тем, что здесь применяется боковое освещение металла, потому что металлы непрозрачны и их невозможно освещать снизу. В таких микроскопах источник света располагается так, чтобы часть лучей отражалась от поверхности металлов и попадала в объектив.

Рис. 1. Металломикроскоп.
Справа сверху — лучи света, отраженные от поверхности шлифа, идут в объектив микроскопа. Справа внизу — поверхность чистого железа, видимая с помощью металломикроскопа.
На рисунке 1 представлен один из таких микроскопов. Прежде чем рассматривать в нем образец, поверхность металла тщательно очищают наждачной бумагой, шлифуют и полируют до зеркального блеска. Такой образец называют шлифом. Затем поверхность шлифа подвергают так называемому травлению, для чего он смачивается в течение 2—3 мин раствором, чаще всего содержащим азотную кислоту и этиловый спирт. Применяют и другие растворы для травления шлифов. Делают это вот для чего: различные зерна сплава неодинаково растворяются кислотой, вследствие чего на поверхности металла выступают отдельные грани кристаллов, и когда протравленную часть шлифа освещают, то часть зерен отражает падающий на них свет прямо на объектив. Эти места под микроскопом кажутся светлыми. Другие зерна отражают свет в сторону, поэтому кажутся темными. Другой оттенок и даже окраску приобретают под микроскопом места сцепления отдельных кристаллических зерен, так называемые межкристаллитные участки (рис. 2).
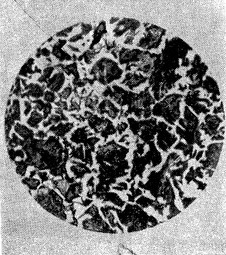
Рис. 2. Шлифованная пластинка под микроскопом (травление стали 2-процентным спиртовым раствором азотной кислоты).
Применение металломикроскопа дало возможность установить, какое строение имеют металлы, как расположены в сплаве отдельные зерна, какие неметаллические включения содержат сплавы, отражение трещин на поверхности сплавов и т. д. На рисунке 3 приведена микрофотография чугуна, где ясно видны отдельные включения графита.
 />
/>Рис. 3. Графит в чугуне (темные включения):
а-крупнопластинчатый графит в обычном сером чугуне; б-мелкопластинчатый графит в модифицированном сером чугуне (модификация 0.15%); в-шаровидные графитовые включения в чугуне, модифицированном магнием (×100).
Металломикроскоп в настоящее время является одним из приборов любой лаборатории, где изучают свойства различных металлов и сплавов.
Кристаллическая решетка металлов
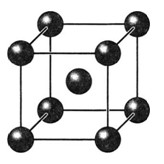
С кристаллами вы уже знакомы. Так, например, изучая поваренную соль, вы знаете, что она состоит из 8 отдельных кристаллов кубической формы. Само слово «кристалл» происходит от греческого слова «кристаллос», означающее «лед». В будущем так стали называть все твердые тела, которые имеют определенную геометрическую форму. В природе подавляющее большинство твердых тел находится в кристаллическом состоянии. Железо как одно из твердых тел при застывании также образует кристаллы. Кристалл железа имеет кубическую решетку. Однако, рассматривая под микроскопом поверхность металла, мы не увидим этой правильной кубической формы кристаллов. Неправильная форма кристаллов возникает потому, что в расплаве при его затвердевании возникает много мельчайших зародышей, которые образуют более крупные кристаллы. Эти крупные кристаллы, сталкиваясь, начинают теснить, сдавливать друг друга. Следовательно, в затвердевающем слитке металла одновременно находится огромное количество кристаллов. Нарушению их формы способствует не только то, что они теснят друг друга, но также неодинаковая температура в различных местах остывания. Отдельные кристаллические зерна в застывшем металле имеют различную форму и величину. Они отделены друг от друга прослойкой, которая состоит из различных неметаллических включений. Эти неметаллические включения всегда присутствуют в том или другом количестве в металле.
Строение металлов
На рисунке 4 представлена схема образования зернистой структуры металла при его застывании.

Рис. 4. Схема роста кристаллов в застывающем расплаве:
а-образуются зародыши; б-растут кристаллы; в-кристаллы начинают теснить друг друга; г-отдельные зерна сращиваются.
Вещества, входящие в состав стали, имеют различную температуру плавления, а, следовательно, и затвердевания. Например, чистое железо становится твердым уже при температуре 1539° С, а в соединении с серой или другими элементами температура затвердевания более низкая. Поэтому слой металла, затвердевающий в первую очередь, состоит из наиболее тугоплавких элементов, например, железа и углерода. Такие примеси, как сера и фосфор, дают более легкоплавкие сплавы и затвердевают в последнюю очередь. Сера и фосфор — вредные примеси потому что их присутствие значительно уменьшает прочность сплава, делает его хрупким и малопригодным для изделий.
При затвердевании сплава более легкоплавкие соединения железа с серой и фосфором концентрируются в верхней части слитка и застывают в последнюю очередь, поэтому сплав железа с фосфором и серой собирается в верхней части слитка.
В кристаллах атомы каждого металла распределяются в строго определенном порядке. Они образуют так называемую пространственную решетку, которую нельзя увидеть ни в один из существующих микроскопов. Однако с помощью рентгеновских установок и других современных приборов можно изучить расположение атомов в кристаллической решетке.
Типы кристаллических решеток металлов
Среди металлов чаще всего встречаются три типа решеток, к первым из них относятся кубические объемноцентрированные. Они характерны тем, что атомы в них находятся в вершинах и центре куба например у лития, хрома, ванадия и других металлов (рис. 5,а).
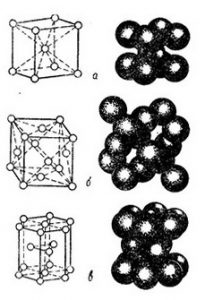
Рис.5. Типы кристаллических решеток металла:
а-кубическая объемноцентрированная;
б-кубическая гранецентрированная;
в-гексагональная (плотная упаковка).
Ко второму типу относят решетку кубическую гранецентрированную (рис. 5,6), атомы в (которой расположены в вершинах куба и его гранях (например, у алюминия, меди, свинца, никеля, золота, серебра и платины).
Третий тип — это гексагональные, или шестиугольные, плотно упакованные решетки (рис.5,в). Они встречаются у магния, цинка, кадмия и бериллия.
Как видно из схемы, приведенной на рисунке 6, наиболее плотные упаковки атомов имеют гранецентрированные и гексагональные решетки.

Рис.6. Схема строения металла.
В узлах решетки положительно заряженные ионы. В промежутка находятся свободные электроны.
Интересно отметить, что некоторые металлы, в частности железо, цинк и никель, могут существовать в нескольких кристаллических формах, переходя из одной в другую. Этот переход совершается при различных температурах. Такие видоизменения, когда одно и то вещество может находиться в различных кристаллических формах, называются аллотропическими, а сами вещества аллотропными. Название «аллотропия» происходит от греческих слов «аллос»—другой, «тропос»—свойство.
Углерод может встречаться в природе в виде графита и алмаза, причем, как вы помните, графит является мягким веществом, оставляющим след на бумаге, в то время как алмаз один из наиболее твердых природных веществ. Температуры плавления алмаза и графита различны.
Известно аллотропическое видоизменение серы (ромбическая и призматическая). Ромбическая сера образуется при температуре ниже 96° С, выше этой температуры она переходит в призматическую. В зависимости от изменения кристаллического строения изменяются и свойства вещества.
Такие же аллотропические изменения наблюдают и у железа. Оно имеет решетку центрированного куба то температуры 910° С, а в интервале температур 910—1390° С совершается переход в гранецентрированную.
Аллотропические превращения металла легко наблюдать на примере олова. Обычное серебристо-белое олово имеет сложную кристаллическую решетку, которая устойчива при температуре выше 18° С, при более низкой температуре атомы олова в кристаллах начинают перестраиваться. Упаковка их (атомов) становится менее прочной, блестящее олово теряет блеск, ковкость и превращается в хрупкое серое олово, имеющее другую кристаллическую решетку.
Это явление было давно замечено и получило название «оловянной чумы», так как оловянные изделия — тарелки из олова, кубки, органы в церкви — иногда вдруг начинали разрушаться. «Оловянная чума» была большим бедствием. Как бороться с ней, не знали, потому что не знали причины ее происхождения. Сейчас нам ясно, что если нагревать изделие из олова, «заболевшее оловянной чумой», то кристаллы серого олова будут перестраиваться в кристаллы белого олова, и оно вновь приобретает ковкость и белый цвет.
Строение металлов
На схемах кристаллов (рис. 5) условно в кристаллической решетке проведены линии, соединяющие один атом металла с другим. В действительности никаких линий, соединяющих атомы, в узлах решетки нет. Они уложены плотно, соприкасаясь друг с другом. В узлах решетки находятся положительно заряженные ионы, окруженные электронами. Валентные электроны атомов металлов так же, как и сами атомы, находятся в беспрерывном колебании. Но внешне электроны (валентные) могут легче покинуть свой атом и перейти к соседнему. Следовательно, в кристаллической решетке имеются так называемые свободные электроны, или свободный электронный «газ», присущий всему комплексу атомов. Таким образом, возникает взаимодействие электронов внешних оболочек атомов металла. Благодаря этому внешнему взаимодействию электронов создается связь между атомами металла, возникают силы сцепления, прочно удерживающие атомы металла в кристаллической решетке (рис. 6). Ионы атомов металлов в кристаллической решетке, окруженные подвижными (незакрепленными) электронами, получили название ион-атомов, в отличие от обычных ионов.
То, что мы говорили о кристаллической решетке металлов, относится к чистым металлам, но мы знаем, что в практике применяют преимущественно сплавы.
Just want to say your article is as astonishing. The clarity on your put up is just excellent and i can suppose you’re a professional
on this subject. Fine along with your permission allow
me to snatch your feed to keep up to date with approaching post.
Thank you one million and please carry on the enjoyable work.
Great site you’ve got here.. It’s hard to find good quality writing like yours these
days. I really appreciate people like you!
Take care!!
Согласен, полезная штука